全文转载自“iNature”公众微信号
细胞外囊泡(EVs)在临床治疗中有多种应用。然而,目前分离血浆EVs的技术存在程序繁琐和产量有限的问题。
2022年11月20日,南方医科大学李博、陈金香及郑磊共同通讯在Journal of Extracellular Vesicles(IF=17)在线发表题为“Rapid and efficient isolation platform for plasma extracellular vesicles: EV-FISHER”的研究论文,该研究开发了一种血浆胞外囊泡的快速高效分离平台:EV-FISHER。该平台由具有可裂解脂质探针(PO43−-间隔物-DNA-胆固醇,PSDC)。EV-FISHER 通过胆固醇从血浆中引诱EVs,并用普通离心机将它们分离。捕获的EVs可以在随后通过脱氧核糖核酸酶I切割PSDC时释放和收集。
EV-FISHER 在时间(40-240 分钟)、隔离效率(74.2%-18.1%)和隔离要求(12,800 g-135,000 g)方面明显优于超速离心(UC)。除了在血浆中的稳定性能外,EV-FISHER还表现出与下游单EV流式细胞术的出色兼容性,能够鉴定glypican-1(GPC-1)EVs,用于乳腺癌队列的早期诊断,临床阶段分化和治疗效果评估。这项工作描绘了一种有效的策略,将EVs从复杂的生物体液中分离出来,具有促进基于EVs的治疗诊断学的潜力。

细胞外囊泡(EVs)是由所有类型的细胞以进化保守的方式释放的磷脂双层包围的颗粒,范围在30到1000纳米之间。越来越多的证据表明,EVs在细胞间通信、疾病发展和进展中发挥着重要作用。特别是EVs携带丰富的生物分子,如蛋白质、核酸、脂类等,具有作为下一代生物标志物的极好潜力。然而,大小不一的EVs存在于生物液体中,例如血浆、血清、尿液和唾液,其中非EVs生物分子占主导地位。
因此,开发一种有效的方法将EVs从复杂流体(如血浆)中分离出来是一项艰巨的挑战。目前,从血浆中分离EVs最常用的方法是差分超速离心(UC)。然而,UC是耗时的,并且会同时分离蛋白质聚集物等污染物。因此,如何以临床友好的方式分离出产量较高的血浆EVs仍然是一个挑战。
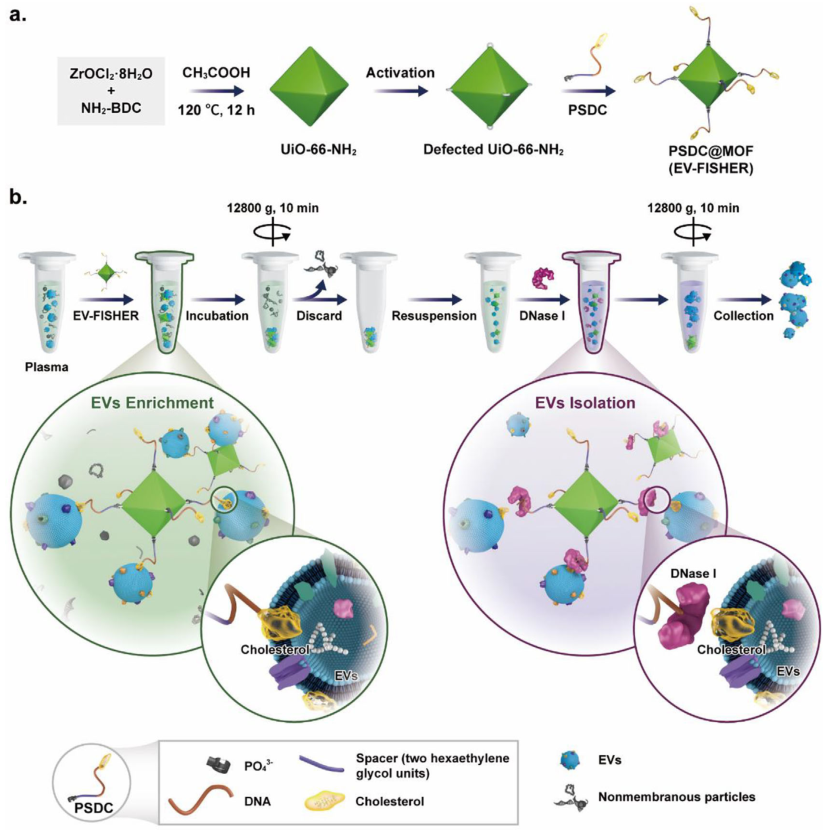
EV-FISHER合成示意图和血浆EVs分离工作流程示意图(图源自Journal of Extracellular Vesicles )
最近,一种脂质纳米探针已被开发用于靶向EVs的磷脂双层以促进其分离。与传统的EVs识别元件相比,脂质纳米探针通过靶向EVs的磷脂双层而不是特定的表面生物大分子(CD63,CD9,磷脂丝氨酸等)捕获EVs。另外,脂质探针和EVs膜之间强烈的疏水相互作用有望产生有效的结合。
因此,这种基于脂质的策略在分离总EV群体方面具有优势,从而为临床判断提供了全面的样本信息。最近,一个抗体辅助的MOF平台已经被开发用于 EVs 分离,命名为 Tim4@ILI-01。然而,这种策略仍然需要费力的修改和长时间的隔离(> 2小时)。因此,基于MOFs的快速高效的EVs隔离平台在很大程度上仍未被开发。
在此,该研究报告了一个称为EV-FISHER的MOF平台,用于EVs 的快速富集和分离。由于这种分离策略的精巧设计,所提出的基于MOF的EV分离平台可以在可用的商业试剂的临床实验室中重复使用。这项工作为在一般临床实验室中快速有效地分离血浆EV以进行下游分析提供了一种有前途的策略。
原文链接:
https://onlinelibrary.wiley.com/doi/full/10.1002/jev2.12281
